由SARS-CoV-2引发的COVID-19对全球公共卫生造成了前所未有的威胁,特别是最新出现的奥密克戎(Omicron)变异毒株在全球范围广泛传播,不断给中和性抗体和疫苗研发带来新的挑战。Omicron变异毒株存在大量突变位点,其中有多达37处突变位于刺突蛋白(Spike)。近期研究显示,目前多种针对SARS-CoV-2的中和性抗体对Omicron变异毒株无效或效力显著降低。因此,深入研究Omicron变异毒株免疫逃逸的分子机制可以为针对SARS-CoV-2的广谱中和性抗体研发提供新思路。
2022年4月15日,南京大学人工智能生物医药技术研究院副院长、南京大学医药生物技术国家重点实验室籍晓云,上海科技大学免疫化学研究所研究员杨海涛/清华大学教授、上海科技大学免疫化学研究所特聘教授饶子和院士,以及重庆医科大学黄爱龙/金艾顺联合团队在Cell Reports上发表题为Structures of Omicron Spike complexes and implications for neutralizing antibody development 的最新研究成果。研究团队利用冷冻电镜单颗粒技术解析了Omicron变异毒株Spike蛋白分别结合受体和抗体的高分辨率结构,从结构生物学角度阐明Omicron 变异毒株逃逸绝大部分现有中和性抗体,同时保留与受体ACE2 有效相互作用的分子机制,为广谱中和性抗体的设计和研发提供了新的思路。

研究团队首先获得了分辨率为2.8 ?的Omicron Spike-ACE2复合物冷冻电镜结构。与野生型(WT) Spike相比,Omicron Spike蛋白受体结合结构域(RBD)上的氨基酸突变位点与受体ACE2第一段α螺旋上的氨基酸残基形成了新的相互作用,因此Omicron Spike仍能紧密结合ACE2。研究团队还通过表面等离子共振(SPR)实验证实了Omicron Spike与受体ACE2的相互作用。
研究团队随后分析了一系列目前已用作新冠肺炎单药或联用治疗的抗体药物结构信息。通过结构比对,研究团队发现Omicron的 RBD 上氨基酸突变位点明显集中在大部分中和性抗体的表位区域。这些突变会引入空间位阻和/或破坏抗体与Omicron的 RBD氨基酸残基之间特定的相互作用。结构分析揭示了Omicron RBD 突变有效地阻断了大部分现有中和性抗体的Fab 与RBD 的结合,而没有破坏ACE2与RBD的结合,这表明RBD 上的突变对受体和抗体具有双重作用。
研究团队进一步解析了中和性抗体510A5分别与WT、Delta和Omicron三种毒株的Spike蛋白的复合物冷冻电镜结构。510A5是从COVID-19恢复期病例血清样本中筛选的一种针对RBD的中和抗体。生化水平结合实验显示,相比WT和Delta,510A5对Omicron Spike蛋白的结合能力有所降低;假病毒中和实验证明了Omicron变异株对510A5的免疫逃逸。冷冻电镜结构显示,WT和Delta的Spike蛋白与510A5 Fab的复合物均存在一种三个“Down”构象RBD的状态,此时三个510A5 Fab均能同时与两个相邻“Down”构象的RBD相互作用,从而将Spike蛋白锁定在受体不可及的关闭状态,阻断病毒的受体识别过程。而Omicron Spike-510A5 Fab复合物有两种结合模式,分别结合三个和两个510A5 Fab,其中Omicron Spike蛋白均有一个RBD处于“Up”构象和两个RBD处于“Down”构象。Omicron RBD的突变位点显著降低了510A5结合RBD的能力,导致三个“Down”构象RBD的状态消失,并产生了一个暴露ACE2结合位点的“Up”构象的RBD,这为解释Omicron变异毒株的免疫逃逸提供了一个直接证据。此外,研究团队还比较了最近报道的对Omicron变异毒株保留一定中和活性的抗体,并分析了这些抗体的表位特征和作用模式,发现第3类和第4类抗体的表位与Omicron的突变位点重合度较小,因此对Omicron变异毒株具有更高的耐受力。通过上述实验结果,研究团队认为通过鸡尾酒抗体同时针对不同表位的治疗策略可能具有很高的临床应用潜力。
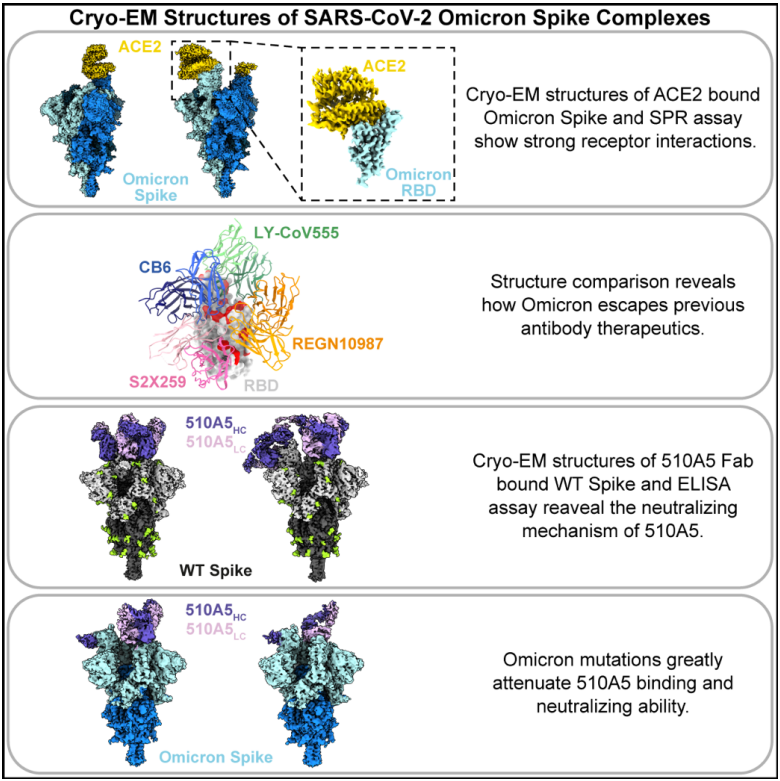
综上所述,本研究揭示了目前最受关注的新冠突变毒株Omicron与ACE2相互作用以及逃逸中和抗体的分子机制,为Omicron免疫逃逸的机制研究提供了新的思路,也为疫苗研发奠定了基础。
南京大学人工智能生物医药技术研究院作为江苏省生物物理学会的运营机构,将会继续助力江苏省的生物物理学研究,为省内科研工作者提供更多联合与交流的平台。