2024年9月17日,南京大学人工智能生物医药技术研究院副院长籍晓云教授联合团队在国际权威期刊《核酸研究》(Nucleic Acids Research)上发表题为“Crystal structure and nucleic acid binding mode of CPV NSP9: implications for viroplasm in Reovirales”的最新研究成果。
研究团队使用生物信息学,生物化学和结构生物学等多种手段,解析了常用的研究模型质型多角体病毒NSP9高分辨率晶体结构,发现了一种全新的蛋白-核酸结合模式,为呼肠孤病毒目病毒复制工厂工作机制的理解提供了全新的线索,也为以病毒复制工厂为靶点的呼肠孤病毒目相关药物研发提供理论基础和独特见解。
双链RNA病毒的代表呼肠孤病毒目(Reovirales)以极其广泛的宿主范围影响着地球上众多生物,其宿主类型包括哺乳动物、鱼类、鸟类、爬行类、节肢动物、藻类、真菌以及植物。该病毒目中的多种成员,如轮状病毒和哺乳动物呼肠孤病毒等,可以导致严重的疾病发生,因此受到全世界研究者的广泛关注。在呼肠孤病毒目的感染过程中,一个典型的特征是形成无膜病毒复制工厂(viroplasm)。这一结构作为病毒复制和组装的场所,扮演着至关重要的角色。viroplasm不仅可以保护病毒免受宿主防御系统的识别和攻击,还促进了病毒基因组的转录和翻译等活动,从而确保病毒的复制和组装过程得以高效进行。然而,目前对于viroplasm工作的分子机制的了解仍然十分匮乏。值得注意的是,病毒的非结构蛋白通常在viroplasm中发挥了重要的调控作用。这些非结构蛋白不仅调控着viroplasm的形成与功能,还深刻影响着病毒的复制效率与致病性。因此,深入研究病毒viroplasm中的关键非结构蛋白可以揭示该病毒目复制工厂的工作机制,为相关疾病的预防与治疗提供重要的科学依据。
研究团队以呼肠孤病毒目质型多角体病毒(CPV)为研究对象,首先通过间接免疫荧光实验和蛋白质共表达发现NSP9与viroplasm潜在骨架NSP8存在一定的相互作用,表明NSP9在viroplasm中扮演重要角色。NSP9的C末端为潜在的内在高度无序区域(IDR),这一特征使NSP9在纯化过程中表现出显著的不均一性和较大程度的聚集倾向。通过制备均一、稳定的NSP9核心(NSP9ΔC)样品,研究团队获得了高质量的蛋白质晶体,利用X射线晶体衍射技术,成功解析了1.8 ? 的NSP9ΔC同源二聚体晶体结构。NSP9ΔC二聚体呈现独特的“乌篷船”(Awning-ship)形态,且具有高度的对称性。Alphafold3等结构预测未能准确呈现其复杂的局部特征,尤其是其稳定的二聚体界面。基于序列和三维结构的比对没有发现数据库中具有显著结构相似性的蛋白质,但研究团队发现一种感染植物的呼肠孤病毒(MRCV)的非结构蛋白P9-1与NSP9具有相似的拓扑结构特征。此外,尽管两者在整体三维结构上并未展现出显著的相似性,但核心区域的三束α螺旋表现出极高的结构相似度。这一发现提示在呼肠孤病毒目的非结构蛋白中,可能存在一类拓扑结构上高度保守的折叠形式,有可能使它们执行尚未完全了解的共同功能。
进一步的生化实验中,研究团队检测了NSP9ΔC与核酸的相互作用特性。结果显示随着蛋白浓度的升高,NSP9ΔC具有依次与单链核酸形成不同形式复合物的能力,在凝胶迁移实验中表现为依次出现两个不同的迁移条带。然而,当使用双链核酸进行测试时,并未观察到类似的现象,表明NSP9ΔC该结合模式严格依赖于单链核酸,体现了其高度的特异性。分析NSP9ΔC二聚体的结构特征发现,NSP9的N端“手臂样”(Arches)结构可以通过分子间作用力进一步形成类似“雨篷”(Awning)的结构。同时,二聚体的底部也通过大量分子间氢键和疏水作用力的紧密协作,形成了一个稳固的“拉链样”(Zipper)二聚界面。这两个结构特点共同作用,围绕并构成了一个封闭的、富含正电荷氨基酸的“通道”(Tunnel)。
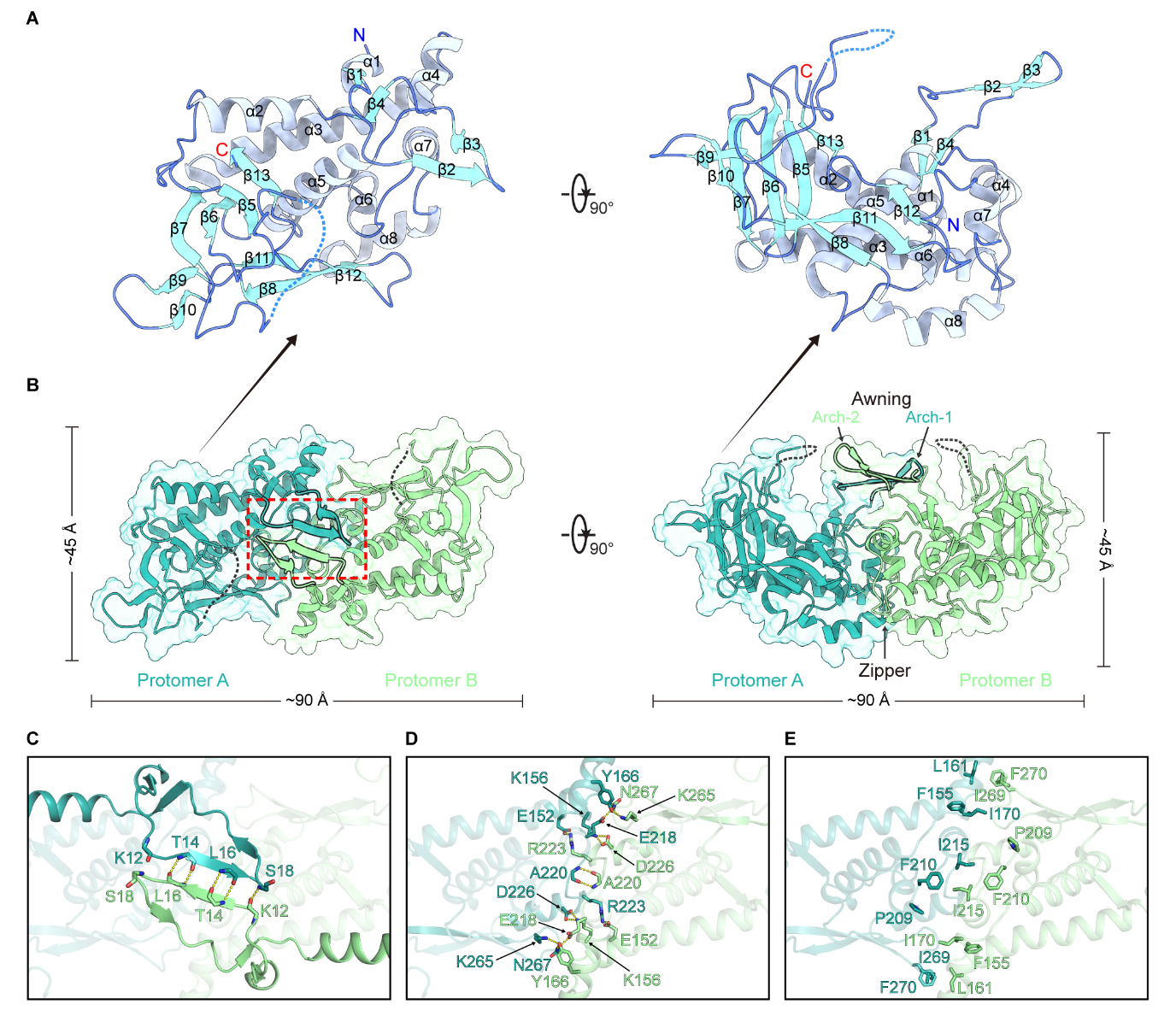
NSP9ΔC晶体结构和同源二聚体相互作用界面
分子对接结果显示,核酸可以结合在该正电荷通道的内部。随后进行的突变实验进一步证实了这一结构特征的重要性:当删除Arches结构区域的氨基酸时,破坏了Awning和Tunnel完整性,导致NSP9ΔC完全丧失了核酸结合能力。其中,第20位的赖氨酸在核酸结合中发挥了重要作用。这些结果进一步加深了我们对NSP9与核酸相互作用机制的认识。
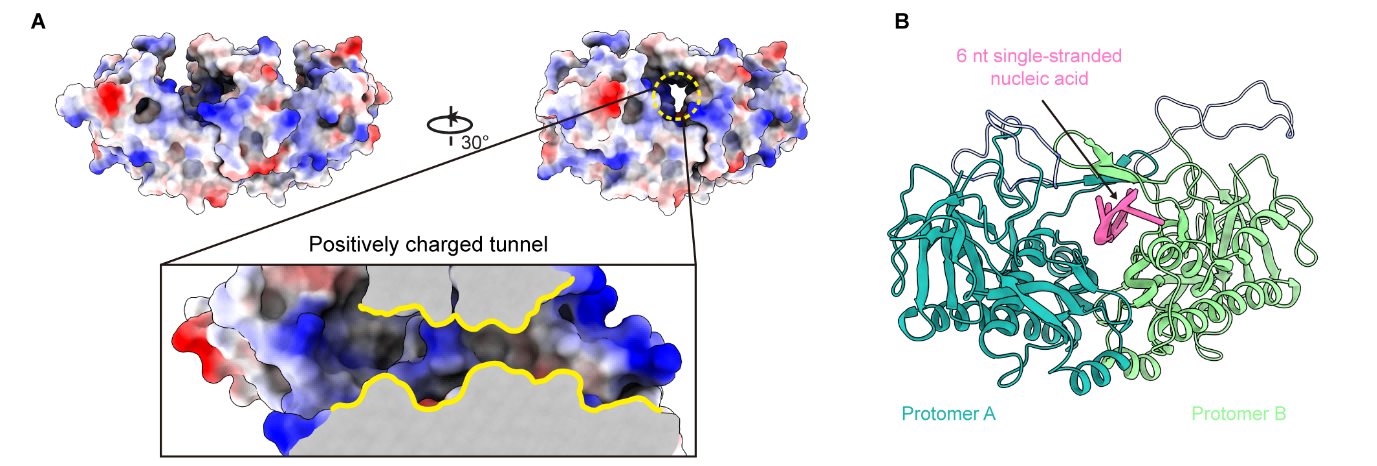
NSP9ΔC二聚体的正电荷“通道”结构可能是单链核酸结合的重要位点
同时,结构信息也可以提供给我们一种合理的蛋白核酸结合模型猜想:由于正电荷氨基酸孔道结构的存在使得NSP9可以潜在的从单链核酸的两端“串入”,从而表现为生化实验观察到的在结合单链核酸时蛋白浓度依赖性的依次出现不同形式的蛋白-核酸复合物的能力。
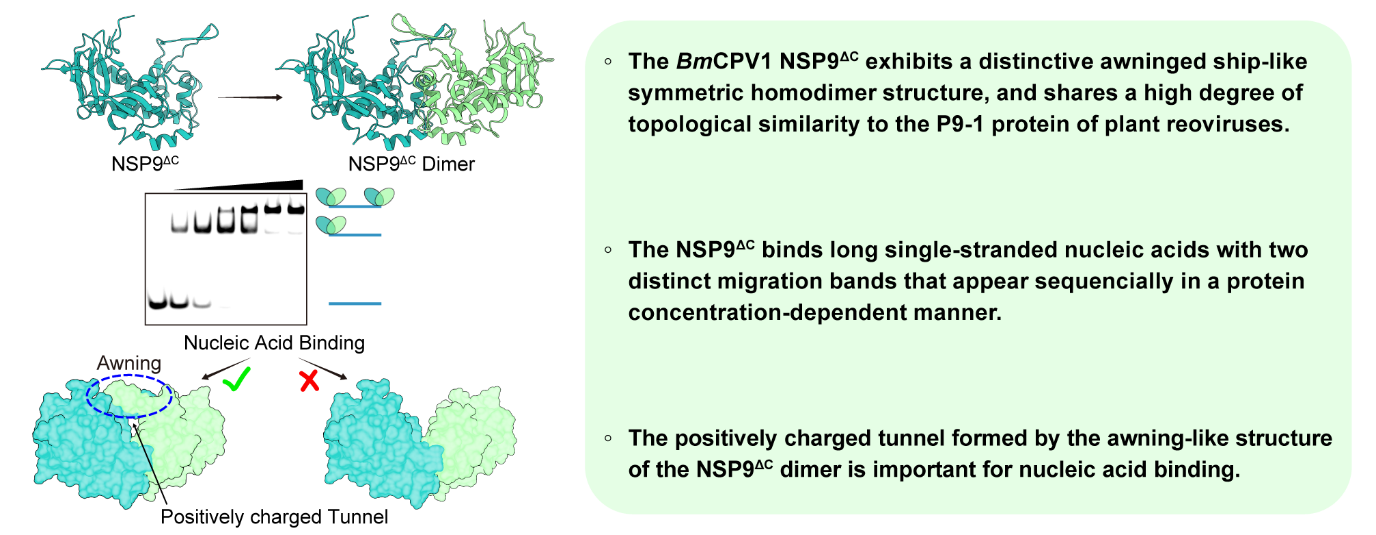
由于viroplasm内大量的转录翻译事件的发生,我们尝试检测已经被广泛报道的翻译调控因子轮状病毒的NSP3,意外的发现NSP3的单链核酸结合模式与本研究发现的NSP9结合模式高度相似,提示我们NSP9可能同样具有潜在的翻译调控功能。

原文链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkae803/7759143